John Dalton (1766-1844) fue un químico y físico británico
que creó una importante teoría atómica de la materia basada en las leyes de la
combinación química. Considerado el padre de la teoría atómica –
molecular. Para Dalton los átomos eran esferas rígidas. Su
teoría se puede resumir así:
• Los elementos
químicos están formados por partículas muy pequeñas e indivisibles
llamadas átomos.
• Todos los átomos
de un elemento químico dado son idénticos en su masa y demás propiedades.
• Los átomos de
diferentes elementos químicos son distintos, en particular sus masas son
diferentes.
• Los átomos son
indestructibles y retienen su identidad en los cambios químicos.
Los compuestos se forman cuando átomos de diferentes
elementos se combinan entre sí, en una relación de números enteros sencilla,
formando entidades definidas (hoy llamadas moléculas).

Sir Joseph John Thomson
(1856 -1940), fue un físico británico que descubrió la existencia
del ELECTRÓN, partícula subatómica cargada negativamente. Según el modelo
de Thomson, conocido como "modelo del pastel de pasas", el átomo
consistía en una esfera uniforme de materia cargada positivamente en la que se
hallaban incrustados los electrones de un modo parecido a como lo están las
semillas en una sandía (patilla). Este sencillo modelo explicaba el hecho de
que la materia fuese eléctricamente neutra, pues en los átomos de Thomson la
carga positiva era neutralizada por la negativa.
Para explicar la formación de iones, positivos y
negativos, y la presencia de los electrones dentro de la estructura atómica,
Thomson ideó un átomo parecido a un pastel de frutas: una nube positiva que
contenía las pequeñas partículas negativas (los electrones) suspendidos en
ella.

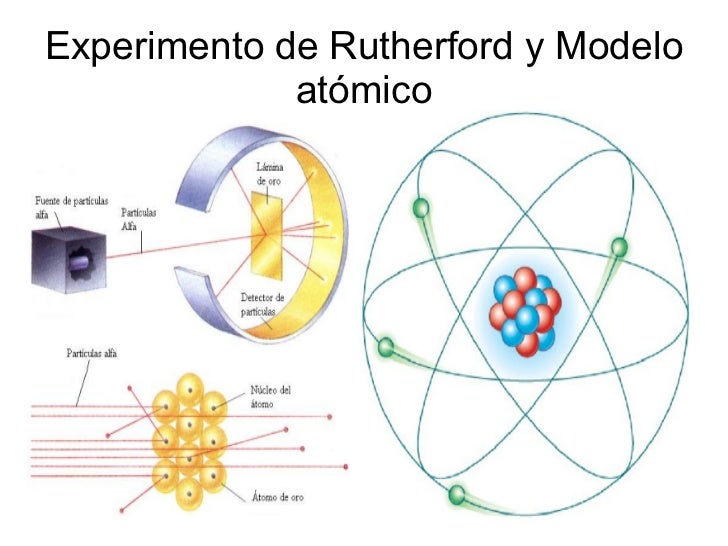
Sir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia
inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neozelandés
que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las
que llamó alfa y beta.
El hecho de que sólo
unas pocas radiaciones sufriesen desviaciones hizo suponer que las cargas
positivas que las desviaban estaban concentradas dentro de los átomos ocupando
un espacio muy pequeño en comparación a todo el tamaño atómico; esta parte del
átomo con electricidad positiva fue llamado
NÚCLEO.
En el modelo de Rutherford, los electrones se movían
alrededor del núcleo como los planetas alrededor del Sol. La carga
eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando
que el átomo sea eléctricamente neutro. Los electrones no caían en el núcleo,
ya que la fuerza de atracción electrostática era contrarrestada por la
tendencia del electrón a continuar moviéndose en línea recta. Este modelo fue
satisfactorio hasta que se observó que estaba en contradicción con una
información ya conocida en aquel momento: de acuerdo con las leyes del
electromagnetismo, un electrón o todo objeto eléctricamente cargado que es
acelerado o cuya dirección lineal es modificada, emite o absorbe radiación
electromagnética.
Después de los
descubrimientos de Rutherford, los científicos pensaron en el átomo como un
sistema solar microscópico, con los electrones girando en órbita alrededor del
núcleo, Bohr al principio supuso que los electrones se movían en órbitas
circulares, pero la física clásica decía que una partícula con carga eléctrica
debía perder energía, lo que llevaría en un momento hacer al electrón caer
hacia el núcleo, entonces Bohr dijo que las leyes conocidas de la física eran
inadecuadas para describir algunos procesos de los átomos. El
físico Danés Niels Bohr, premio Nobel de Física en 1922, introdujo en 1913 los
tres postulados siguientes:
Primer Postulado: El producto del impulso o cantidad de
movimiento (mv) del electrón por la longitud de la órbita que describe es un
múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un electrón gira en una
orbita fija no emite energía radiante.
Tercer Postulado: Un electrón puede saltar desde una
orbita de energía a otra inferior de menor energía. En este salto el átomo
emite una cantidad de energía radiante igual a la diferencia de energía de los
estados inicial y final.
Aunque la teoría de Bohr fue de gran utilidad, tenía fallas,
para empezar años después el electrón se identificó con un comportamiento de
onda y en este modelo eso no se tomó en cuenta, además el modelo solo
funcionaba para el hidrógeno, dejando fuera las relaciones electrón - electrón
en átomos de muchos electrones.

El físico E. Schrödinger estableció el modelo
mecano-cuántico del átomo, ya que el modelo de Bohr suponía que los electrones
se encontraban en órbitas concretas a distancias definidas del núcleo; mientras
que, el nuevo modelo establece que los electrones se encuentran alrededor del
núcleo ocupando posiciones más o menos probables, pero su posición no se puede
predecir con exactitud.
Con estas dos partículas, se intentó construir todos los
átomos conocidos, pero no pudo ser así porque faltaban unas de las partículas
elementales del núcleo que fue descubierto por J. Chadwick en 1932 y que se
llamó neutrón. Esta partícula era de carga nula y su masa es ligerísimamente
superior a la del protón (1,6748210-27kg.). Sin negar el considerable avance
que supuso la teoría atómica de Bohr, ésta solo podía aplicarse a átomos muy
sencillos, y aunque dedujo el valor de algunas constantes, que prácticamente
coincidían con los valores experimentales sencillos, el modelo no fue capaz de
explicar los numerosos saltos electrónicos, responsables de las líneas que
aparecen en los espectros de los átomos que poseen más de un electrón. Al
modelo de Bohr se le fueron introduciendo mejoras, pero la idea de un átomo
compuesto por orbitas alrededor de un núcleo central puede considerarse
demasiado sencilla, no fue posible interpretar satisfactoriamente el espectro
de otros átomos con más de un electrón (átomos poli electrónicos) ni mucho
menos la capacidad de los átomos para formar enlaces químicos












0 comentarios:
Publicar un comentario